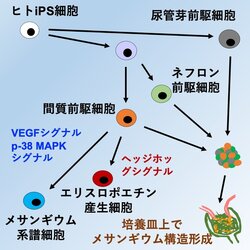
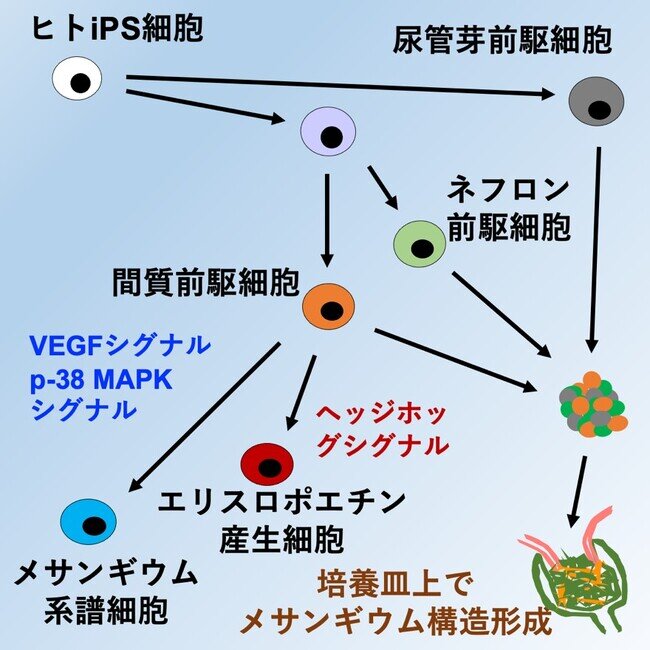
ヒトiPS細胞から腎間質前駆細胞の選択的な分化誘導法を開発し糸球体メサンギウム構造を有する腎組織を体外で作製することに初めて成功
2024年1月18日(木)15時17分 PR TIMES
詳細は京都大学iPS細胞研究所(CiRA)およびリジェネフロから配信されました、以下のプレスリリースをご確認ください。
・ ヒトiPS細胞から腎間質前駆細胞注1)を選択的に分化誘導する方法を開発した。
・ ヒトiPS細胞由来のネフロン前駆細胞注2)との共培養により、腎間質前駆細胞はメサンギウム構造注3)を形成した。
・ 腎間質前駆細胞から腎エリスロポエチン注4)産生細胞を作製する方法を開発した。
・ メサンギウム系譜細胞の分化にp38 MAPKシグナル注5)が重要であることを明らかにした。
1. 要旨
辻本啓 共同研究員(CiRA増殖分化機構研究部門/リジェネフロ株式会社)、長船健二 教授(CiRA同部門)らは、リジェネフロ社およびアストラゼネカ社(英国本社)との共同研究により、ヒトiPS細胞から腎間質前駆細胞の選択的な分化誘導法を開発し、メサンギウム構造を持った糸球体を含む腎組織を体外で作製することに世界で初めて成功しました。
さらに、間質前駆細胞から腎エリスロポエチン産生細胞やメサンギウム系譜細胞を培養皿上で作製し、それぞれの分化に重要なシグナルを明らかにしました(図1)。本成果は、ヒト腎臓の発生生物学の新たな知見と腎臓疾患の仕組みの解明や腎臓の再生医療開発に向けた研究に貢献することが期待されます。
この研究成果は、2024年1月18日午前1時(日本時間)に米科学誌「Cell Reports」で公開されました。
[画像1: https://prtimes.jp/i/24308/460/resize/d24308-460-a79e3e3578e166ef3a6b-0.jpg ]
2. 研究の背景
腎臓は、血液をろ過し、尿を作ることに加えて、血圧を調整するホルモンのレニンや赤血球を作るために必須のホルモンのエリスロポエチンの産生と分泌も行います。
腎臓の間質のもとになる腎間質前駆細胞は、腎臓の複雑な構造の形成に寄与する間質細胞や糸球体のメサンギウム細胞およびエリスロポエチン産生細胞に分化すると考えられています。メサンギウム系譜の細胞は、糸球体の中で毛細血管をつなぎ止める「メサンギウム構造」を糸球体足細胞とともに形成することに加え、レニンを産生し血圧の調整を行います。
現在、末期慢性腎不全の患者さんには、腎臓の機能を回復させる腎臓移植が唯一の根治的な治療法となっています。しかし、提供される腎臓が圧倒的に不足しており、再生医療が待ち望まれています。また、特に腎臓の間質は、腎線維化の主要な部位であり、糸球体機能と腎疾患の病態に重要な役割を果たすことから、腎間質の細胞の作製はさまざまな腎疾患の研究に利用できると期待されています。本研究では、ヒトiPS細胞からの腎臓組織の作製のため、特に腎間質前駆細胞を選択的に分化させることで、腎間質の細胞群の発生と分化を解明することを目指しました。
これまでに、幹細胞から誘導した腎発生初期の細胞種をマウスの体内に移植しメサンギウム構造を形成した例や、間質細胞を含む腎組織に類似したオルガノイドの作製に成功した例が報告されています。また、マウス胚性幹(ES)細胞から分化させた複数種の細胞が混在する培養中から、特定の細胞を回収し、分化誘導を行うことで腎間質前駆細胞を作製した報告があります。しかし、ヒトiPS細胞から腎間質前駆細胞を選択的に作製し、細胞培養でメサンギウム構造の形成を誘導した報告はこれまでになく、培養方法の改善が必要でした。
3. 研究結果
1)ヒトiPS細胞から腎間質前駆細胞の選択的な分化誘導法の開発
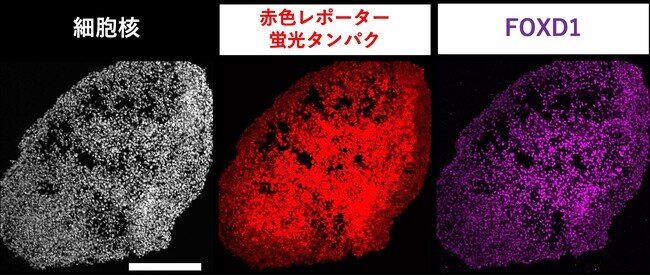
研究グループはまず、腎間質前駆細胞マーカーのFOXD1を発現する細胞で、蛍光タンパク質が発現するようにしたiPS細胞株を作製しました(図2)。さらに、マウスの発生初期の遺伝子発現を解析することで、腎間質前駆細胞の発生に関連すると考えられるシグナル経路をいくつか同定しました。
腎間質前駆細胞とネフロン前駆細胞はどちらも中胚葉注6)からの発生過程に分化します。研究グループは、シグナル経路などを解析することで開発したネフロン前駆細胞の分化誘導法(CiRAニュース2020年4月8日 https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/200408-010000.html )をもとに、途中から誘導法を改変することで、腎間質前駆細胞の作製に成功しました。
[画像2: https://prtimes.jp/i/24308/460/resize/d24308-460-60090a0dcf9459e184b7-1.jpg ]
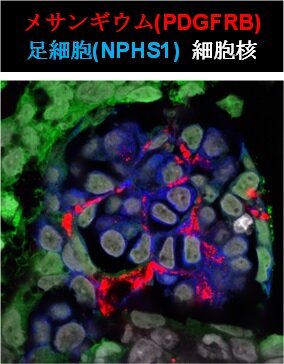
2)ヒトiPS細胞由来の3種の細胞の共培養によるメサンギウム構造の形成
続いて、研究グループは、腎間質前駆細胞の分化能力を確かめるために、ヒトiPS細胞から作製したネフロン前駆細胞と尿管芽細胞注7)との共培養を行いました。増殖因子と低分子化合物の組み合わせや培養条件を改変した結果、足細胞の間にメサンギウム細胞が入り込むメサンギウム構造が形成され、発生期にみられるキャップ状構造注8)などが保たれる条件を見出しました(図3)。
[画像3: https://prtimes.jp/i/24308/460/resize/d24308-460-4ab4a00493d08f944347-2.jpg ]
3)メサンギウム系譜細胞の分化と発生にp38 MAPKシグナルが重要であることを解明した
レニン産生細胞などのメサンギウム系譜細胞は腎間質前駆細胞から分化します。研究グループは、腎間質前駆細胞の分化能力をさらに確かめるために、メサンギウム系譜細胞を誘導できるかを検証しました。その結果、腎間質前駆細胞からレニンを産生するメサンギウム系譜細胞へ分化する条件を見出しました(図4)。また、分化方法の検討の結果として、腎間質前駆細胞からメサンギウム系譜細胞への分化にp38 MAPKシグナルの活性化が重要であることを見出しました。
[画像4: https://prtimes.jp/i/24308/460/resize/d24308-460-28f9dc35034c92c23339-3.jpg ]
体内の腎臓の発生においても、メサンギウム系譜細胞への分化にp38 MAPKシグナルの活性化が関わるかどうかを調べるため、公開されているヒト胎児腎臓の1細胞レベルでの網羅的遺伝子発現データを用いて、発生期腎臓における腎間質前駆細胞からレニン陽性のメサンギウム系譜細胞への分化シグナルを解析しました。すると、ヒトiPS細胞からの分化誘導と同様にp38 MAPKシグナルの活性化を見出しました。
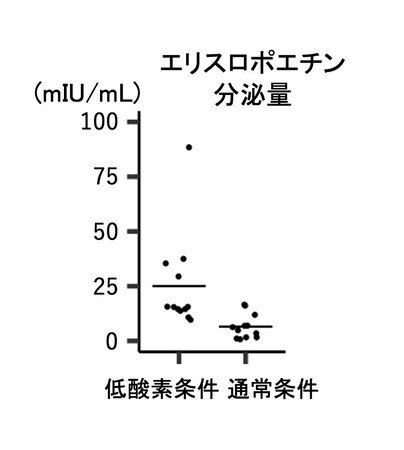
4)腎間質前駆細胞から腎エリスロポエチン産生細胞の分化誘導法の開発
最後に、研究グループは、腎間質前駆細胞の分化誘導因子や、低酸素シグナルに関連する低分子化合物を検討し、腎間質前駆細胞から腎エリスロポエチン産生細胞を作製する方法を開発しました(図5)。その結果、ヘッジホッグシグナル注9)などのシグナルが腎エリスロポエチン産生細胞の分化に重要であることを明らかにしました。
[画像5: https://prtimes.jp/i/24308/460/resize/d24308-460-e5dd9b9b37090c26e24c-4.jpg ]
4.まとめと展望
研究グループは、ヒトiPS細胞からメサンギウム系譜細胞と腎エリスロポエチン産生細胞を生み出すことができる腎間質前駆細胞の選択的な誘導法を開発しました。そして、p38 MAPKシグナルがメサンギウム系譜細胞の発生と分化において重要な役割を果たしていることを明らかにしました。今回の腎間質前駆細胞の分化システムが、腎臓の発生と再生研究、腎疾患の病態解明や腎臓の生理機能の解明に貢献することが期待されます。
5.コメント
「この腎間質前駆細胞の開発は、私たちのチームが数年にわたり精力的に取り組んできた成果です。これは医学の未来を変え、腎臓病の患者さんに新たな治療法を提供する可能性を秘めています」(CiRA長船健二教授)
「アストラゼネカと京都大学の卓越した研究者との協力は、イノベーションの原動力でした。私たちは、この先駆的な技術を実用化し、腎臓病の患者さんに希望と健康をもたらすことに注力していきます」(リジェネフロ社)
「ヒト腎臓の発生に関する知識は、腎臓病に関連するメカニズムを理解し、効果的な医薬品開発プログラムを推進するために不可欠です。私たちは、腎幹細胞系列の分化ならびに腎臓の細胞の構造に関する新たなサイエンスを解明する本共同研究に参加できたことをうれしく思います」(アストラゼネカ社)
6.論文名と著者
○論文名
“Selective induction of human renal interstitial progenitor-like cell lineages from iPSCs reveals development of mesangial and EPO-producing cells”
○ジャーナル名
Cell Reports
○著者
Hiraku Tsujimoto1,2, Azusa Hoshina1, Shin-Ichi Mae1, Toshikazu Araoka1, Changting Wang1, Yoshihiro Ijiri1, May Nakajima-Koyama1, Satoko Sakurai1, Kazusa Okita1, Ken Mizuta3, Akira Niwa1, Megumu K Saito1, Mitinori Saitou1,3,4, Takuya Yamamoto1,4,5, Cecilia Graneli6, Kevin J Woollard6 and Kenji Osafune1*
* : 責任著者
○著者の所属機関
1. 京都大学iPS細胞研究所(CiRA)
2. リジェネフロ株式会社
3. 京都大学大学院医学研究科
4. 京都大学高等研究院ヒト生物学高等研究拠点(WPI-ASHBi)
5. 理化学研究所
6. アストラゼネカPLC
7.本研究への支援
本研究は、以下の支援を受けて実施されました。
・国立研究開発法人 日本医療研究開発機構(AMED)(JP23bm1123002, JP22bm0104001, JP22bm0804013, JP22bk0104113)
・リジェネフロ株式会社
・アストラゼネカPLC
・iPS細胞研究基金
8.用語説明
注1) 腎間質前駆細胞
腎臓の糸球体の足細胞や尿細管、集合管などの上皮以外の間質に分化することができる前駆細胞のこと。生体内で赤血球を誘導するホルモンであるエリスロポエチンや、血圧を調整するレニンなどのホルモンを作る細胞も腎間質前駆細胞から分化する。
注2) ネフロン前駆細胞
ヒトやマウスでは発生期の腎臓にのみ存在し、糸球体と尿細管に分化することによって腎臓の機能の最小単位であるネフロンをつくる前駆細胞のこと。
注3) メサンギウム構造
糸球体足細胞と腎間質前駆細胞から生じるメサンギウム細胞が融合した組織。糸球体機能と腎疾患の病態に重要な役割を果たす。
注4) エリスロポエチン
赤血球の産生に必須のホルモンで、成体では腎臓で産生される。
注5) p38 MAPKシグナル
p38 MAPKは、細胞外の刺激を細胞核内の転写制御機構へとつなぐシグナル分子の一つ。ストレスや炎症性サイトカインにより活性化されることが知られている。
注6) 中胚葉
受精後の胚からできる細胞の塊はまず、内胚葉、中胚葉、外胚葉に分けられる。その後、内胚葉は、消化器官や呼吸器官を、外胚葉は、神経や感覚器官を形成する。中胚葉は、さらに側板中胚葉、中間中胚葉、沿軸中胚葉などに分かれ、側板中胚葉と沿軸中胚葉の間に生じる中間中胚葉が、腎臓、生殖腺などを含む泌尿生殖系の器官を形成する。
注7) 尿管芽
胎生期の腎臓前駆組織の一つ。将来尿の排出路である集合管、下部尿路系などに分化する。
注8) キャップ状構造
形成中の腎臓の特徴的な構造の一つ。尿管芽をネフロン前駆細胞と腎間質前駆細胞が取り囲んで(キャップ)帽子状の構造を作る。
注9) ヘッジホッグシグナル
細胞外シグナル因子の一つで、胚発生において細胞の増殖や分化、形態形成において重要な役割を果たすことが知られている。
以上
*****
CiRAについて
京都大学iPS細胞研究所(CiRA)では、iPS細胞作製技術を用いて創薬、新しい治療法の開発、病気の原因の解明や再生医療への応用を実現するための研究を行っています。詳細についてはhttps://www.cira.kyoto-u.ac.jp/をご覧ください。
リジェネフロについて
リジェネフロは、CiRA 増殖分化機構研究部門の長船健二教授の研究成果を基に、2019年9月に設立されたスタートアップ企業です。長船教授はネフロン前駆細胞の存在を世界で初めて発見したのを皮切りに、iPS細胞からネフロン前駆細胞を高効率に作製する技術の確立などに成功してきました。リジェネフロは腎疾患に対する様々なソリューションを研究開発し、腎疾患に苦しむ患者さんのQOLの改善により社会に貢献することを目指しています。詳細についてはhttps://www.regenephro.co.jp/をご覧ください。
アストラゼネカについて
アストラゼネカは、サイエンス志向のグローバルなバイオ医薬品企業であり、主にオンコロジー領域、希少疾患領域、循環器・腎・代謝疾患、呼吸器・免疫疾患からなるバイオファーマ領域において、医療用医薬品の創薬、開発、製造およびマーケティング・営業活動に従事しています。英国ケンブリッジを本拠地として、当社は100カ国以上で事業を展開しており、その革新的な医薬品は世界中で多くの患者さんに使用されています。詳細についてはhttps://www.astrazeneca.com または、ソーシャルメディア@AstraZeneca(https://www.linkedin.com/company/astrazeneca/)をフォローしてご覧ください。
日本においては、主にオンコロジー、循環器・腎・代謝、呼吸器・免疫疾患およびワクチン・免疫療法を重点領域として患者さんの健康と医療の発展への更なる貢献を果たすべく活動しています。アストラゼネカ株式会社についてはhttps://www.astrazeneca.co.jp/ をご覧ください。フェイスブックAstraZeneca.Japan (https://www.facebook.com/AstraZeneca.Japan/)とインスタグラム AstraZeneca / アストラゼネカ(https://www.instagram.com/astrazenecajapan/)もフォローしてご覧ください。