【東京農業大学(共同研究)】乳がん増悪化の新規メカニズムを発見
2025年4月23日(水)14時0分 Digital PR Platform
神経ペプチド受容体VIPR2 二量体化の分子機構の解明から創薬へも期待
[画像1]https://digitalpr.jp/simg/2209/108016/700_136_2025041411402267fc7596dda06.png
[画像2]https://digitalpr.jp/table_img/2209/108016/108016_web_1.png
論文掲載
【本研究成果のポイント】
乳がん細胞内で、神経ペプチド受容体VIPR2が二量体化することを明らかにし、これが乳がんの増殖や転移に不可欠であることが分かりました。
VIPR2の二量体化を防ぐことで乳がんの進行を止める新薬の開発が期待されます。
【概要】
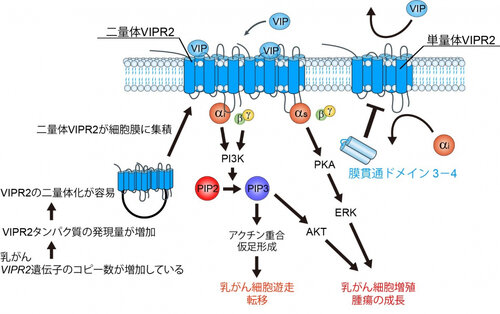
広島大学大学院医系科学研究科細胞分子薬理学 浅野 智志 助教、吾郷 由希夫 教授、東京農業大学生命科学部バイオサイエンス学科 中澤 敬信 教授らの研究グループは、乳がん細胞増殖・遊走に関わる受容体VIPR2が二量体を形成し、この二量体化を阻害することで腫瘍の成長や転移を著しく抑制できることを発見しました(図1)。
私達の研究室では、乳がんにおいてVIPR2遺伝子のコピー数(※1)やVIPR2 mRNAの発現が増加していることに着目し、VIPR2の乳がん細胞における機能解析を進めています。最近、VIPR2が乳がん細胞遊走(Asano et al., Front. Oncol. 2022)や乳がん細胞増殖(Asano et al., Peptides 2023; J. Pharmacol. Sci. 2024)を制御する重要な分子であることを明らかにしました。
今回、私達は、VIPR2が二量体を形成することを明らかにし、また、同定した二量体化に必要な領域(細胞膜の貫通ドメイン3−4)をがん細胞に過剰発現させることで競合的に二量体化を阻害できることを見いだしました(図2)。さらに、この膜貫通ドメイン3−4を発現する乳がん細胞株を作製し、マウスに移植することで、生体内におけるVIPR2の二量体と単量体の機能の違いを解析することに成功し、単量体ではなく、二量体VIPR2が乳がんの増悪化に関与していることを明らかにしました(図3、図4)。今回の結果は、VIPR2の二量体化を阻害する膜貫通ドメイン3−4のペプチドが新規抗がん剤候補となる可能性を示しています。
本研究成果は、2025年4月9日(水)に英国薬理学雑誌「British Journal of Pharmacology」にオンライン掲載されました。
本研究は令和4年度 広島大学基金「のぞみH基金」がん医療研究推進助成金(浅野)、JSPS科研費 [課題番号23K091380(浅野)、23K24550(柳本)、20H03392(吾郷)、24K02185(吾郷)]、国立研究開発法人日本医療研究開発機構 [課題番号 JP19gm1310003(中澤)、JP21wn0425012(中澤)] により研究助成を受けて実施しました。また、広島大学から論文掲載料の助成を受けています。
[画像3]https://digitalpr.jp/simg/2209/108016/700_439_2025041411425967fc7633bd3d0.jpg
図1. 二量体VIPR2が関与する乳がん増悪化のメカニズム
<発表論文>
論文タイトル
Dimerisation of the VIP receptor VIPR2 is essential to its binding VIP and Gαi proteins, and to its functions in breast cancer cells
著者
浅野 智志1,2※、小笹 かいり2、上原 輝1,3、横山 玲1,2、中澤 敬信4、柳本 惣市2,3、吾郷 由希夫1,2※
1. 広島大学大学院医系科学研究科細胞分子薬理学
2. 広島大学歯学部
3. 広島大学大学院医系科学研究科口腔腫瘍制御学
4. 東京農業大学生命科学部バイオサイエンス学科
* 責任著者
掲載雑誌
British Journal of Pharmacology(Q1)
DOI番号
10.1111/bph.70039
【背景】
乳がんは、世界的にみて女性で最も罹患数の多いがんです。世界で約230万人、日本においては約9万人の方が毎年新たに罹患しているといわれています。原発巣で増殖した非浸潤がん(がんができた場所にとどまっている状態)が進行して浸潤がん(周囲の組織や血管などに広がる状態)になると、リンパ節や肺などに転移し、致死率が高くなります。
私たちの身体の中には神経ペプチドというタンパク質が存在します。神経ペプチドは身体が特定の刺激を受けると放出され、細胞の表面にある神経ペプチド受容体と結びつくことで、例えば痛みを抑えたり、気分を良くしたりするなど、様々な働きをします。神経ペプチドも神経ペプチド受容体も、その働きによっていくつもの種類が存在しますが、その中の一つにVIPR2という神経ペプチド受容体があります。これは特定の神経ペプチドと結びつくことで、血流改善や消化促進、ストレスの調整などの効果を発揮しますが、これまでの研究で、乳がん細胞内において、VIPR2を作り出す設計図であるVIPR2 mRNAやVIPR2遺伝子のコピー数が増加(※1)することが報告されていました。
一方、VIPR2はGタンパク質共役型受容体(GPCR)の一種であり、GPCRに属するいくつかの受容体は二量体化(二つの同じ分子が結びついて一つのまとまりになること)することが報告されていますが、その生理学的な意義はほとんど分かっていません。また、GPCRの中でもVIPR2が二量体化するのかについては、知られていませんでした。一般的にGPCRの二量体化は、発現増加などによるGPCR数の増加に伴って自然発生的に起こります。もしVIPR2が二量体化するのであれば、VIPR2 mRNAの発現が増加している乳がん細胞では、他のがん種と比較してVIPR2が二量体化しやすい可能性が考えられました。
そこで本研究では、まずVIPR2が乳がん細胞内で二量体を形成するか否かを検証し、二量体を形成するのであれば、それが乳がんにおいてどのような役割を果たしているのかを明らかにすることを目的として検討を行いました。
【研究成果の内容】
本研究では、VIPR2が乳がん細胞内で二量体を形成しており、VIPR2-VIPR2間の結合に細胞膜貫通ドメイン3−4の領域が必須であることを発見しました。また、膜貫通ドメイン3−4ペプチドの競合結合性を利用して、VIPR2を脱二量体化させることに成功しました(図2)。この膜貫通ドメイン3−4を発現する乳がん細胞株を樹立し、マウスに移植することで、生体内における二量体と単量体の機能の違いを解析することが可能になり、その結果、二量体VIPR2が乳がん細胞の増殖(図3)や転移(図4)に不可欠な分子であることを明らかにしました。さらに、二量体化がVIPR2とVIPとの親和性やVIPR2とGαiタンパク質との結合性を調節していることを示し、VIPR2シグナルの新たな制御メカニズムを解明しました。
つまり、VIPR2が乳がん細胞内で二量体化し、この二量体VIPR2が乳がんの増殖や転移を促進させる分子であることを示しました。
【今後の展開】
膜貫通ドメイン3−4の発現が乳がん細胞の増悪化を抑制できたことから、今後は精製した膜貫通ドメイン3−4ペプチドの制がん作用を動物モデルを用いて検証し、VIPR2の発現増加によって二量体化が亢進しているがん細胞を標的とする新規抗がん剤の開発研究を進めていきたいと考えています。
[画像4]https://digitalpr.jp/simg/2209/108016/700_763_2025041411472867fc7740a1062.jpg
図2. 膜貫通ドメイン3−4の発現が、VIPR2−VIPR2間の距離を遠ざけ、二量体化を阻害する。(A)VIPR2-VIPR2間の距離の広がりは蛍光共鳴エネルギー移動(FRET)光退色法によって検討した。VIPR2-EGFP(ドナー分子)とVIPR2-mCherry(アクセプター分子)間の距離が二量体を形成するくらい接近して存在している場合、ドナーからアクセプター分子へエネルギーが移動するFRETが起こる(光退色前)。この時、アクセプター分子に強い光を照射することで光退色させると、ドナーからのエネルギーの移動が起きず、光退色前と比較してドナーの蛍光強度が増加する(左図)。一方、VIPR2間の距離が二量体を形成できない程に離れており、FRETが起きない場合、アクセプター分子の光退色前後でドナーの蛍光強度は変化しない(右図)。(B)コントロール細胞では、アクセプター分子の光退色前と比較して光退色後でドナーの蛍光強度は1.25倍に増加しFRETが検出されたのに対して、膜貫通ドメイン3−4をがん細胞に発現させると、光退色前後でドナーの蛍光強度は変化しておらず、VIPR2−VIPR2間の距離が離れていることがわかる。
[画像5]https://digitalpr.jp/simg/2209/108016/700_342_2025041411480167fc7761b0fc9.jpg
図3. 膜貫通ドメイン3−4を発現させた乳がん細胞は、移植したマウス生体内において、その増殖が抑制される。膜貫通ドメイン3−4を過剰発現させた乳がん細胞MDA-MB-231またはコントロール細胞をヌードマウスの乳腺近傍に移植し、腫瘍の成長の様子を経時的に観察した。グラフは移植部位における腫瘍のサイズを示している。
[画像6]https://digitalpr.jp/simg/2209/108016/700_493_2025041411483467fc77827facf.jpg
図4. 膜貫通ドメイン3−4を発現させた乳がん細胞は、移植したマウス生体内において、その転移が抑制される。(A) 膜貫通ドメイン3−4を過剰発現させた乳がん細胞BT-549またはコントロール細胞をヌードマウスに移植し、腫瘍の成長と浸潤の様子を経時的に観察した。(B) 各がん細胞を移植後10週のマウスからリンパ節を取り出し、蛍光イメージャーを用いてがん細胞を可視化した。
<用語説明>
(※1)コピー数
常染色体上のゲノムDNAは通常1体細胞当たり2コピーであるが、個々人により1コピー以下しか存在しない領域(欠失)、もしくは3コピー以上存在する領域(重複)があり、コピー数変化あるいはコピー数多型とよぶ。コピー数変化が生じている領域に存在する遺伝子の発現量に影響がみられる。
本件に関するお問合わせ先
東京農業大学 学長室 企画広報課
TEL: 03-5477-2650 / FAX: 03-5477-2804 / Email: info@nodai.ac.jp